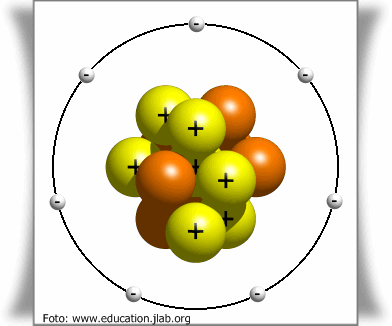
Menurut BOHR, teori atom mekanika kuantum merupakan suatu studi mengenai hukum - hukum yang berkaitan dengan gerakan yang melibatkan partikel yang berukuran sangat kecil. Struktur atom yang dikembangkan oleh BOHR dengan kulit - kulit elektronnya belum dapat menjelaskan beberapa fenomena, seperti sifat keparamagnetikan unsur, terbentuknya bilangan oksidasi suatu unsur, posisi unsur transisi dalam table periodeik unsur, ketidakteraturan harga energi ionisasi, serta kestabilan ion atau unsur.
Lain halnya dengan pengertian teori atom mekanika kuantum yang dicetuskan oleh ERWIN SCHRODINGER. Teori atom mekanika kuantum menurut ERWIN mirp dengan yang diajukan oleh model atom BOHR, yaitu atom memiliki inti bermuatan positif dikelilingi oleh elektron - eletron bermuatan negatif. Perpedaannya terletak pada posisi elektron dalam mengelilingi inti atom. Awal ERWIN mengemukakan teori ini adalah karena didorong oleh kegagalan teori atom BOHR dalam menerangkan spektra atom hidrogen dalam medan magnet dan medan listrik.
Menurut teori atom mekanika kuantum, posisi elektron dalam mengelilingi inti atom tidak dapat diketahui secara pasti. Hal ini sesuai dengan teori ketidakpastian Heisenberg. Sehingga dengan kata lain, orbital adalah daerah kebolehjadian terbesar ditemukannya elektron dalam atom. Sedangkan menurut model atom mekanika kuantum, gerakan elektron dalam mengelilingi inti atom tersebut memiliki sifat dualisme seperti yang diajukan oleh DE BROGLIE. Karena gerakan elektron dalam mengelilingi inti memiliki sifat seperti gelombang, maka persamaan gerak elektron dalam mengelilingi inti harus terkait dengan fungsi gelombang. Sehingga bisa disimpulkan bahwa energi gerak kinetik elektron harus diungkapkan dalam persamaan fungsi gelombang.
Persamaan yang menyatakan gerakan elektron dalam mengelilingi inti atom tersebut dihubungkan dengan sifat dualisme materi yang diungkapkan dalam bentuk koordinat Cartesius. Hal tersebut terkenal dengan istilah persamaan SCHRODINGER. Persamaan SCHRODINGER ini menghasilkan 3 bilangan kuantum, yaitu: BIlangan kuantyum utama, bilangan kuantum azimut, dan bilangan kuantum magnetik. Ketiga bilangan kuantum tersebut merupakan bilangan bulat sederhana yang menunjukkan peluang adanya elektron di sekelling atom. Penyelesaian dari persamaan SCHRODINGER ini menghasilkan 3 bilangan kuantum dimana orbital diturunkan dari persamaan SCHRODINGER sehingga terdapat hubungan antara orbital dan ketiga bilangan kuantum tersebut.